1. 特異な構造特性を持つ分子の合成と機能化
非平面アミドの化学
私たちは、二環性骨格を持つアミド1およびチオアミド2(図1)が顕著に非平面化した構造を持つことをX線結晶構造解析や温度可変Dynamic NMRの手法により明らかにしました。アミドAは非平面化による構造の歪みに起因する回転障壁の低下が見られました。非平面アミドAと平面アミドBの回転速度には約3倍の違いがあります。この発見は有機構造化学として極めて基礎的で好奇心を駆り立てるものです。この現象を引き起こす要因は今も未決着な研究対象です。
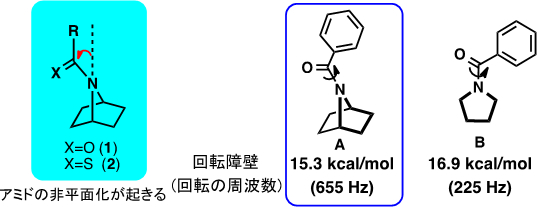
図1.二環性アミドの非平面化とアミド結合の回転障壁(エネルギー)
β–アミノ酸プロリンミミックによる新規へリックスの構築
このような有機構造論的な研究を行っている途中で、非平面化したアミド窒素原子、すなわち柔軟性のあるアミド結合を、アミノ酸誘導体のペプチド結合に用いた時に、ペプチド高次構造は形成されるのかどうか。また形成されるならどのような高次構造が作られるかという着想を得ました。そのため、この有機構造化学の発見はペプチド分野の研究の意味合いを持つことになりました。合成法を立案して、構造を解析する研究に着手しました。
すなわち、二環性骨格を持つβ–アミノ酸を提案し、このホモオリゴマーの構造を調べました。通常タンパク質に存在するアミド結合(secondary amide)はほぼトランス体のみをとりますが、プロリンアミドに代表されるtertiary amideはシス・トランスどちらも平衡で存在し得ます(図2)。二環性β−アミノ酸もtertiary amideを形成します。アミドのシス・トランス平衡の制御という問題に遭遇しました。
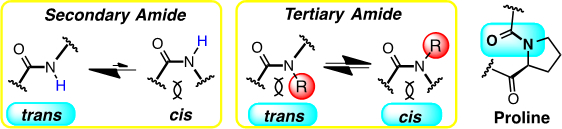
図2.アミドのシス・トランス平衡
様々な計算実験の結果、この二環性構造では、橋頭位(C-1 位またはC-4位、図3)に置換基を1個導入することによりアミドのシス−トランス平衡を効果的に制御できることを見出し、ホモオリゴマー分子を実際合成して、それぞれシスアミドからなるヘリックスおよびトランスアミドからなるヘリックス構造を作り出せることが判明しました(図3)。しかも、これらのヘリックス構造は水を含む各種溶媒中で安定で構造を維持することが分かりました。環境に依存しない堅牢な予測可能な構造を取る規則構造が創製できました。
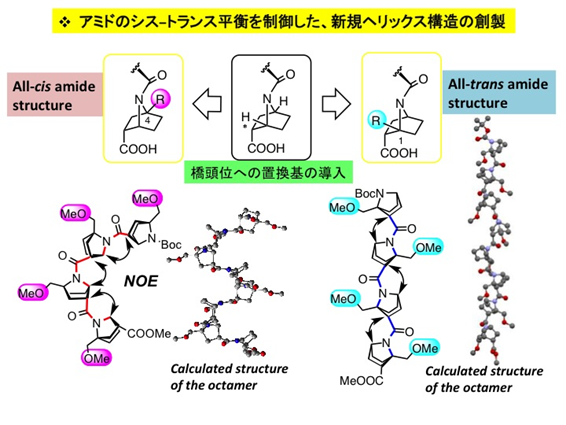
図3 二環性アミドを用いるシス-ヘリックスおよびトランス-ヘリックスの創製
水中で安定な最小原子数の規則構造の研究と機能化
多くのタンパク質は、α-ヘリックスやβシートなどの規則的な折りたたみ構造を基盤として高次構造を形成します。この規則性形成の主要因として、全てのペプチド結合(アミド結合)が硬い平面構造をとるために主鎖が取りうる形が制限されることが挙げられます。
柔軟性を増したβ—プロリンアミノ酸誘導体は意外にも、規則構造(ヘリックス構造)の形成を容易にしているという研究結果を得ています。その様なことが一般性あることなのかを検証することも私たちの研究テーマの重要な興味の一つです。一方、現在世界中の研究者がタンパク質のフォールディングモデルとしての「もっとも小さなタンパク質の創製」を目指しています。ここで言うタンパク質とは、ヘリックスやターンなどの規則構造を持つペプチドを意味します。しかも規則構造は水という生体に必須な溶媒中で安定でなければいけません。私たちの研究は、規則構造誘起の最小単位の発見という意味でこの世界規模のテーマへの挑戦でもあることを強調したいと思います。
ところで、ヘリックス構造の創出にどのような機能が期待できるでしょうか? Gタンパク質共役型レセプター(GPCR: G-Protein-Coupled Receptor)やイオンチャネルなどの膜タンパク質の持つ生体機能の重要さは論を待ちません。これらの膜タンパク質は、細胞膜である脂質二重膜を貫通する膜貫通領域(Transmembrane Domain、TM)を複数もち機能構造を形成しています。この膜貫通領域はヘリックス構造をとります。つまりヘリックス構造は生体膜を交通できる可能性があります。またバイオロジーにおいて「シグナル伝達」と呼ばれる現象は、タンパク質-タンパク質間の厳密な表面認識から始まります。多くのタンパク質-タンパク質相互作用は、ヘリックス間の相互作用から成り立つことが知られています。巨大分子量をもつタンパク質を最小限の原子数からなる堅牢な規則構造で置き換えられるかもしれません。
【関連する研究成果】
Wang, S. et al. J. Org. Chem. ,2014, 79, 5287-5300.
Hosoya, M. et al. J. Am. Chem. Soc. 2010, 132, 14780-14789.
Hori, T. et al. J. Org. Chem. 2008,73, 9102-9108.
Otani, Y. et al. J. Am. Chem. Soc. 2003, 125, 15191-15199.
非平面アミドの化学の展開:非平面ニトロソアミンの構造と一酸化窒素(NO)転位反応と一酸化窒素(NO)放出の機能化
アミドを非平面化させた7−アザビシクロ[2.2.1]ヘプタン構造はN−ニトソロアミンの非平面化も引き起こすことが分かりました。N-ニトロソアミンも通常は平面構造をとります。このN−ニトソロアミンの非平面化はN−NO結合が弱くなっていることを期待させました。そのため、様々なニトロソアミンを合成して有機溶媒を助溶媒として水に溶かしてみました。残念なことに生体と同じpHである7.4では何も起きませんでした。しかし、チオールが共存していると面白い反応が起きることが分かりました。硫黄原子の求核的な攻撃によって,硫黄原子に二環性の化合物が持つNO基が移動するS−トランスニトロソ化反応を引き起こしたのです(図4)。生成したS−ニトロソチオールのS−NO結合は自発的に解裂して一酸化窒素(NO)を放出することが知られているので間接的なNO放出が可能になりました。一方で、タンパク質の機能調整として特定のシステイン残基がS-ニトロソ化される(SNO)ことの重要性が認識されてきています。私たちのN−ニトソロアミン分子は生体中でSNO化化合物としての機能を発揮できるでしょうか?この点について精力的に研究を行っています。そしてこの概念が実験的に支持され始めました。また、直接NOをpH7.4で発生させることはできないでしょうか?私達の二環性ニトロソアミンは可視光照射でNOを放出するCaged-NOであることを世界で初めて解明しました。
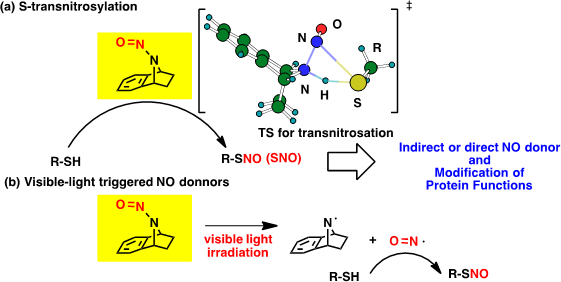
図4(a)一酸化窒素転位反応と(b)可視光刺激による一酸化窒素放出
【関連する研究成果】
Kozai, D. et al. Molecular Pharmacology, 2014, 85, 175-185.
Makita, N. et al. Circulation Research, 2013, 112, 327-334.
Karaki, F. et al. Chemistry - A European Journal, 2012, 18, 1127-1141.
Ohwada, T. et al, Bioorganic & Medicinal Chemistry, 2011, 19, 2726-2741.
Yanagimoto, T. et al. J. Am. Chem. Soc., 2007, 129,736-737.
Ohwada, T. et al, J. Am. Chem. Soc., 2001, 123, 10164-10172.
